
正丁(盐酸托莫西汀胶囊)
发布时间:2021-04-25浏览次数:
|
【药品名称】 通用名称:盐酸托莫西汀胶囊 商品名称: 英文名称:Atomoxetine Hydrochloride Capsules 汉语拼音:Yansuan Tuomoxiting Jiaonang 【成 份] 化学名称:R-(-)-N-甲基-3- (2-甲基苯氧基)-3-苯丙 胺盐酸盐 化学结构式: 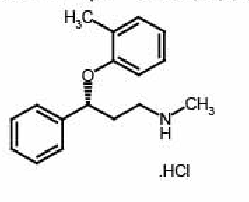 |
 |
分子量:291.82
【性状】
本品为硬胶囊,内容物为白色至类白色粉末。
【适应症】
盐酸托莫西汀用于治疗儿童和青少年的注意缺陷/多动障
碍( ADHD)。
【规格】
10mg(以C17H21NO计)
警示语
儿童青少年的自杀意念
在患有注意缺陷/多动障碍(ADHD)的儿童和青少年中
进行的短期研究发现,盐酸托莫西汀胶囊的使用增加了产生
自杀意念的风险。任何人考虑让儿童和青少年服用托莫西汀
时必须对这种风险和临床需要进行权衡。ADHD的并发疾病
可能与自杀意念和/或行为的风险增加有关联。对所有开始
服用盐酸托莫西汀胶囊治疗的患者,应该密切监测其自杀倾
向(自杀的想法和行为).临床症状的恶化以及异常的行为
改变。建议家人和看护者有必要对患者进行密切观察并与处
方医师保持交流沟通。托莫西汀胶囊未被批准用于抑郁症患
者。
在儿童和青少年中(包括2200多名患者参加的共12项
试验,其中11项ADHD试验.1项遗尿症试验)进行的关于
盐酸托莫西汀胶囊短期(6到18周),安慰剂对照的临床试
验汇总分析显示:与安慰剂相比,接受盐酸托莫西汀胶囊治
疗的患者在治疗早期产生自杀意念的风险更高。在接受盐酸
托莫西汀胶囊治疗的患者中,其产生自杀意念的平均风险为
0.4%(5/1357患者),而使用安慰剂治疗的患者(851例)
没有这一风险。在所有的试验中没有自杀事件的发生。(参
见【注意事项】)
【用法用量】
初始治疗
体重不足70kg的儿童和青少年的用量开始时,盐酸托莫
西汀的每日总剂量应约0.5mg/kg,并且在3天的最低用量
之后增加给药量,至每日总目标剂量,约为1.2mg/kb,可
每日早晨单次服药或早晨和傍晚平均分为两次服用。剂量超
过1.2mg/kg/日未显示额外的益处。
对儿童和青少年,每日最大剂量不应超过1.4mg/kg或
100mg,选其中较小的一个剂量。
体重超过70kg的儿童、青少年和成人用量 开始时,盐酸
托莫西汀的每日总剂量应为40mg,并且在3天的最低用量后
增加给药量.至每日总目标剂量,约为80mg,可每日早晨
单次服药或早晨和傍晚平均分为两次服用。再继续使用2到
4周后,如仍未达到最佳疗效,每日总剂量最大可以增加到
100mg.没有数据支持在更高剂量下会增加疗效。
对体重超过70kg的儿童和青少年以及成人,每日最大推
荐总剂量为100mg。
维持/长期治疗
通常认为.ADHD可能需要长期的药物治疗。一项对照临
床研究结果证明,6-15岁患有注意缺陷/多动障碍
(ADHD)的儿童和青少年在使用1.2-1.8mg/kg/日剂量取
得治疗效果后,继续维持盐酸托莫西汀治疗是有益的。因此
接受盐酸托莫西汀维持治疗的患者通常应继续使用其在开放
用药阶段取得治疗效果相同的剂量。如果医生选择长期使用
盐酸托莫西汀,应定期再评价长期治疗对患者的有效性。
一般用药须知
盐酸托莫西汀可以与食物同服或分开服。
停止治疗时,不需要逐渐减量。
尚未系统评价单次服药剂量超过120mg或每日总剂量超过
150mg的安全性。
肝功能损伤患者的剂量调节 伴肝功能不全(HI)的
ADHD患者的剂量调节建议如下:中度HI患者(Child-Pugh
Class B),初始和目标剂量应降至常规用量(对不伴HI的
患者)的50%;重度HI患者(Child-Pugh Class C),初始
和目标剂量应降至常规用量的25%(见【药代动力学】项下
特殊人群)。
与CYP2D6强抑制剂联合使用或已知属于CYP2D6弱代谢
型患者(CYP2D6 PMs)的剂量调节 服用CYP2D6强抑制
剂如帕罗西汀、氟西汀、奎尼丁,或已知属于CYP2D6弱代
谢型患者,且体重不足70kg儿童和青少年.盐酸托莫西汀
的初始剂量应为0.5mg/kg/日;只有当4周后症状未见改善并
且初始剂量有很好的耐受性时,才增加至通常的目标剂量
1.2mg/kg/日。
服用CYP2D6强抑制剂如帕罗西汀、氟西汀、奎尼丁,且
体重超过70kg儿童、青少年和成人,盐酸托莫西汀的初始
剂量应为40mg/日;如果4周后症状未见改善并且初始剂量
有很好的耐受性时,可增加至通常的目标剂量80mg/日。
注意缺陷/多动障碍的诊断等问题
ADHD(DSM-IV)诊断是指在7岁以前,表现多动-冲动
或注意力不集中症状,并引起功能损伤。症状必须是持续
的、必须比同等发育水平的个体的常见表现更严重、必须引
起有临床意义的功能受损,如生活、学习或工作能力等受
损、必须表现在2个或以上的场所,如学校(或单位)和家
中。症状必须不是源于其他精神疾病。对于精力不集中
型,至少有下列中6个症状,并且必须持续至少6个月:缺少
对细节的注意/粗心所致的错误、缺乏持续注意力、难以认
真听讲、不能坚持完成任务、缺乏组织性、回避需要持久脑
力活动的任务、丢东西、容易注意分散、健忘。对于多动-
冲动型,至少有下列中6个症状,并且必须持续至少6个月:
坐立不安/辗转不安、离开座位、非适当的跑/攀爬、难
以进行安静活动、多动、多话、插嘴、不能等待(难以遵守
秩序)、干扰他人。对于混合型,应符合注意力不集中和多
动-冲动的标准。
诊断注意点
关于ADHD的明确的病因学还不清楚,也没有单独的诊断
性测试。充分的诊断不仅需要利用医学的.还要运用特殊心
理学、教育和社会的资源。学习可能受到影响或不受影响。
诊断必须建立在患者完整的病史和全面的评价基础上,不能
仅根据DSM-IV中所要求的临床表现。
综合治疗计划的需要
对于这种病症的患者,盐酸托莫西汀是ADHD整体治疗计
划的一部分,还应包括其他方法(心理的,教育的、社会
的)。对于本病症,药物治疗可能不适合于所有患本病症的
患者。药物治疗不适用于ADHD症状继发于环境因素和/或其
它原发性精神疾病(包括精神病)的患者。对于被诊断为该
病的儿童和青少年,进行适当的教育是必要的,心理社会干
预常有帮助。当单独的治疗方法不充分时,医生要根据患者
症状持续的时间和程度对其进行药物治疗。
长期用药
尚无盐酸托莫西汀在儿童/青少年(超过9周)和成人
ADHD(超过10周)的中长期疗效的对照临床研究数据。因
此,医生如选用盐酸托莫西汀延长治疗,应定期对每个患者
长期用药的疗效进行再评价。
【不良反应】
盐酸托莫西汀已经在5382名ADHD的儿童和青少年和
1007名成年中进行了临床研究。在ADHD临床试验中,
1625名患者的治疗时间超过1年,2529名患者的治疗时间超
过6个月。
因为临床试验的情况各有不同,一种药物临床试验中发现
的不良反应发生率不适与另一种药物临床试验的不良反应发
生率直接比较,且可能无法反映医疗实践中实际的不良反应
发生率。
儿童和青少年临床试验
在儿童和青少年研究中,因不良事件中止治疗的原因 在
短期儿童和青少年安慰剂对照研究中,有3.0%( 48/1613)
在托莫西汀治疗组和1.4%(13/945)在安慰剂组的患者园
不良事件中止治疗。在所有的研究中(包括开放和长期研
究),6.3%的强代谢(EM)患者和11.2%的弱代谢
(PM)患者因不良事件中止了研究。在接受盐酸托莫西汀
治疗的患者中,造成1个以上的患者中止治疗的原因为易激
怒(0.3%,n=5),嗜睡(0.3%,n=5),攻击行为
( 0.2%,n=4),呕吐(0.2%,n=4),腹痛(0.2%,
n=4),便秘(0.1%,n=2).疲劳(0.1%,n=2),感觉异
常(0.1%,n=2)和头痛(0.1%,n=2)。
癫痫在产品上市前的临床研究中没有入选癫痫患者,因
此对盐酸托莫西汀在癫痫儿童中的使用情况没有进行过系统
性评价。在上市后的临床研究中,平均年龄为10岁的儿童
(6到16岁)报道癫痫的发生率为0.2%(12/5073)。在这
些临床研究中癫痫风险发生率强代谢患者为0.2%
( 11/4741).弱代谢患者为0.3%(1/293)。
在儿童和青少年短期安慰剂对照试验中常见的不良事件
表1列出了盐酸托莫西汀组最常见(发生率≥2%)但在安慰
剂组不常见(在盐酸托莫西汀治疗组中的发生率高于安慰剂
组)的不良事件。除表2中列出的在每日两次和每日一次中均
可见的不良事件外,每日两次与每日一次治疗的结果相近。
在接受盐酸托莫西汀治疗中,最常见的不良事件(发生率为
5%或以上和至少为安慰剂组发生率的2倍,在每日两次或每
日一次剂量组):恶心、呕吐、消化不良、疲劳、食欲不
振、腹痛和嗜睡(见表1和表2)。
1这些反应至少由2%以上使用托莫西汀治疗的患者报告,
并且比用安慰剂者多。下列不良事件不符合这一标准,但与
安慰剂相比,托莫西汀组有更多患者报告这些不良事件,而
且可能与托莫西汀治疗有关:血压升高、早醒、兴奋、瞳孔
扩大、窦性心动过速、虚弱、心悸、情绪波动、便秘。下列
不良事件在使用托莫西汀的患者中至少有2%的报告.并且
相等于或少于安慰剂组:咽喉痛、失眠(包括初期失眠症和
中期失眠症)。下列不良事件不符合这一标准,但显示有统
计学意义的剂量相关性:瘙痒。
2腹痛包括上腹痛、腹痛、胃部不适、腹部不适和上腹部
不适。
3嗜睡包括镇静和嗜睡。
1腹痛包括上腹痛、腹痛、胃部不适、腹部不适和上腹部
不适。
2便秘没有统计学意义但由于符合药理作用的可能性而列
于表中。
3隋绪波动没有达到0 .05的统计学显著性但P值<0.1(趋
势性)。
下列不良事件在PM患者的发生率至少2%.与EM患者相
比,发生频率或是其2倍或是有统计学意义:失眠( 15%
PM,10%EM);体重降低(7%PM.4%EM);镇静状
态(4%PM,2%EM);便秘(7%PM,4%EM);抑郁
(7%PM,4%EM);震颤(5%PM.1%EM);表皮脱
落(4%PM.2%EM);结膜炎(3%PM.1%EM):晕
厥( 3%PM,1%EM);早醒(2%PM,1%EM);瞳孔
扩大( 2%PM,1%EM)。
成人临床试验:
成人短期安慰剂对照研究中,因不良反应中止治疗的原
因 在成人短期安慰剂对照研究中,因不良反应中止治疗的
比率,托莫西汀治疗组中为11. 3%(61/541).安慰剂组
为3.0%(12/405)。盐酸托莫西汀治疗组中,1人以上的
患者由于:失眠( 0.9%,N=5);恶心(0.9%,N=5);
胸痛(0.6%,N=3);疲劳(0 .6%,N=3);焦虑
(0.4%,N=2);勃起障碍(0.4%,N=2);情绪波动
(0.4%,N=2);紧张不安(0.4%,N=2);心悸
(0.4%,N=2)和尿潴留(0.4%,N=2)等原因中止治
疗。
癫痫 在产品上市前的临床研究中没有入选癫痫患者,因
此对盐酸托莫西汀在成人癫痫患者中的使用情况没有进行
过系统性评价。在上市后的临床研究中,报道成人癫痫的
发生率为0.1%(1/748)。在这些临床中,癫痫风险发生
率强代谢患者为0.1%( 1/705),弱代谢患者为0(0/4
3)。
成人短期安慰剂对照研究中常见的不良反应 表3列出了
与盐酸托莫西汀治疗相关的常见不良事件(发生率≥2
%),且高于安慰剂组。盐酸托莫西汀治疗组中最常见的
不良事件(发生率≥5%和至少为安慰剂组中发生率2倍)
的为:便秘、口干、恶心、疲劳、食欲不振、失眠、勃起
障碍、尿急和/或尿潴留和/或排尿困难,痛经以及潮热(见
表3)
1以上为盐酸托莫西汀治疗相关的常见的不良事件(发生
率≥2%),且高于安慰剂组。不符合这一标准,可能与托
莫西汀治疗有关,且发生率高于安慰剂组的不良事件有:
早醒、四肢厥冷、心动过速、前列腺炎、睾丸痛以及性高
潮异常等。接受托莫西汀治疗的患者中至少有2%有报告,
并且等于或少于安慰剂组的不良事件有:头痛、咽喉痛、
易怒。
2腹痛包括上腹痛、腹痛、胃部不适、腹部不适和上腹部
不适。
3嘻睡包括镇静和嗜睡。
4失眠包括失眠、初期失眠和中期失眠。
5基于所有受试男性(盐酸托莫西汀.n=326;安慰剂,
n=260)。
6基于所有受试女性(盐酸托莫西汀.n=214;安慰剂,
n=142)。
男性和女性的性功能障碍 托莫西汀在一些患者中引起性
功能受损。性欲和性行为的改变、性满意度在大多数研究
中没能够得到很好的评价,因为患者和医生不愿意就以上
问题进行讨论。因此,引证在说明书中的对不愉快的性体
验和性行为发生率可能会低于实际的发生率。上表列出的
是在安慰剂对照研究中,接受盐酸托莫西汀治疗的至少有
2%的成人患者中报告的性方面不良反应发生率。
没有对接受盐酸托莫西汀治疗出现性障碍进行充分的和
规范的对照调查研究。尽管很难知道盐酸托莫西汀用药导
致性功能障碍的明确的危险性,医生应常规地调查这方面
的可能的不良反应。
上市后的自发报告
以下列出盐酸托莫西汀上市后自发报告的不良反应。因
为这些不良反应是由不确定数量的患者自发报告的,因此
不太可能准确估计其发生频率或建立与药物暴露的因果关
系。
心血管系统 Qt间期延长,晕厥。
癫痫 上市后有癫痫发生的报道,上市后的癫痫病例中包
括此前已有癫痫史的患者、证明存在癫痫发生风险的患者
以及既无癫痫病史也没有证明癫痫发生风险的患者。由于
不能确定ADHD患者的癫痫风险发生背景.所以难以对使
用盐酸托莫西汀与癫痫发作之间的明确关系进行评价。
泌尿生殖系统 男性骨盆腔痛。
【禁 忌】
过敏
盐酸托莫西汀禁用于已知对托莫西汀或该产品其他成分
过敏的患者(见【注意事项】)。
单胺氧化酶抑制剂(MAOI)
盐酸托莫西汀不应与MAOI合用,或在停用MAOI两周内
使用。同样,MAOI治疗不应在停用盐酸托莫西汀两周内开
始。已有报道称,其他影响脑内单胺浓度的药物与MAOI合
用可引起严重的、甚至致命的反应(包括高热、强直、肌
阵挛、自主神经系统功能不稳定,可能出现生命体征的快
速波动,以及精神状态改变,包括可发展为谵妄和昏迷的
极度激越)。有些病例表现出类似神经阻滞剂所致的恶性
综合征的特点。这类反应可能在这些药物同时使用或清洗
期过短时发生。
狭角性青光眼
在临床研究中,使用盐酸托莫西汀与增加使瞳孔扩大的
危险性有关,因此,本品不推荐在患有狭角性青光眼的患
者中使用。
【注意事项】
自杀意念
在患有注意缺陷,多动障碍(ADHD)的儿童和青少年中
进行的短期研究发现,盐酸托莫西汀胶囊的使用增加了产
生自杀意念的风险。在儿童和青少年中进行关于盐酸托莫
西汀胶囊短期的(6-18周)安慰剂对照的临床试验汇总
分析显示:那些接受盐酸托莫西汀胶囊治疗的患者在治疗
的早期具有更高的产生自杀意念的风险。12项试验(关于
ADHD的11项试验和遗尿症的1项试验)共计2200多名患
者(包括1357名接受盐酸托莫西汀胶囊治疗的患者,和
851名接受安慰剂治疗的患者)。在接受盐酸托莫西汀胶
囊治疗的患者中,其产生自杀意念的平均风险为0.4%
(5/1357患者),而使用安慰剂治疗的患者没有这一风
险。在这些约2200名患者中,有1名使用盐酸托莫西汀胶
囊的患者企图自杀。在所有的试验中没有自杀的发生。所
有的事件均发生为在12岁及以下的儿童中。所有的事件均
发生在治疗的第一个月内。在儿科患者中产生自杀意念风
险的结论是否可以推广到长期研究中还不清楚。一个相似
的分析在使用盐酸托莫西汀胶囊治疗ADHD或者严重的抑
郁性障碍(MDD)患者中进行,并没有发现与盐酸托莫西
汀胶囊使用相关的产生自杀意念或行为风险的增加。
对所有使用盐酸托莫西汀胶囊治疗的儿科患者应该密切
监测其自杀倾向,临床症状的恶化以及异常的行为改变,
特别是在药物治疗的最初几个月,或在剂量改变(无论增
加还是降低剂量)的治疗阶段。
使用盐酸托莫西汀胶囊治疗后的症状包括:焦虑、激
越、惊恐发作、失眠、易激惹、敌意、攻击行为、冲动、
静坐不能(精神运动性不安)、轻躁狂和躁狂。尽管这些
症状的出现与自杀冲动出现之间没有因果的关联,但这些
症状可能代表了自杀倾向出现的前兆。因此,应该对使用
盐酸托莫西汀胶囊治疗的患者出现这些症状进行观察。
患者出现自杀倾向或出现可能的自杀倾向的先兆,特别
是如果这些症状很严重或突然发作,或不是患者现有症状
的一部分时,应当考虑改变治疗方案,包括可能停止药物
的使用。
应当警告接受盐酸托莫西汀胶囊治疗的儿童患者的家庭
成员和护理人员有必要每日监测患者出现激越、易激惹、
异常的行为改变,以及其他如上描述的症状和自杀倾向的
出现,并立即向有关医务人员报告。
严重肝脏损伤
上市后报告显示盐酸托莫西汀在极个别的情况下可能导
致严重肝功能受损。尽管在有大约6000名患者参加的临床
试验中并没有观察到发生肝功能受损的病例,但在上市后
的临床应用中有极少病例被认为可能与使用盐酸托莫西汀
有关的明显肝功能受损。由于可能存在漏报,因此要准确
的评估服用盐酸托莫西汀可能造成的这种不良反应是不可
能的。其中一个患者表现为肝酶(达到40倍正常值上限)
和黄疸(胆红素达12倍正常值上限)升高,当再次给药时
出现同样症状,停药后即恢复,因此表明盐酸托莫西汀可
能会引起肝功能受损。这样的反应可能在开始治疗后几个
月出现,但实验室指标的异常可能在停药后数周内达到最
差状态。上述患者的肝功能已恢复,且不需要肝移植。但
是必须注意的是,药物所致的严重肝功能受损存在潜在的
发展成急性肝功能衰竭,从而导致死亡或需要接受肝移植
的可能。
在患者出现黄疸或实验室检查结果显示肝功能受损时应
停用盐酸托莫西汀,并不能重新用药。当患者出现肝功能
障碍的最初症状和体征(如:瘙痒,黑尿,黄疸,右上腹
压痛或难以解释的“流感样”症状)时应对其进行实验室
检查以确定肝酶值。
严重心血管事件
猝死及先天性心脏结构异常或其他严重心脏疾病
儿童和青少年 报告显示在心脏结构异常或患有其他严重
心脏疾病的儿童和青少年中使用常规剂量的托莫西汀发生
过与给药有关的猝死。虽然一些严重的心脏疾病本身具有
较高的引起猝死的风险,但患有已知严重的心脏结构异
常、心肌病、严重心律失常或其他严重心脏疾病儿童或青
少年患者对托莫西汀产生的去甲肾上腺素效应的敏感性更
高,因此托莫西汀通常不得用于上述儿童或青少年患者。
成人 报告显示使用常规剂量治疗ADHD成人患者,发生
过猝死、中风及心肌梗塞。虽然托莫西汀在这些成人患者
中所起的作用尚不明确,但患严重心脏结构异常、心肌
病、严重心律失常、冠心病或其他严重心脏疾病的成人的
可能性比儿童更大,因此应该注意本品不得用于治疗临床
诊断有明显心脏疾病的成人患者。
在使用托莫西汀治疗的患者中应对心脏功能进行评定
对考虑使用托莫西汀治疗的儿童、青少年以及成人应进
行详细的病史(包括对家族猝死或心律不齐的评定}和体
检,以评估可能出现的心脏疾病,如发现这类疾病的症状
(如心电图和超声心动图l者应接受进一步的心脏功能评
定。如患者在托莫西汀治疗期间出现提示发展成心脏疾病
的胸痛、不明原因的晕厥或其他症状,应立即接受心脏功
能评定。
对血压和心率的影响
因为盐酸托莫西汀会引起血压升高和心率加快,因此,
患有高血压,心动过速或心、脑血管疾病的患者应注意。
在治疗前、剂量增加时和治疗中应定期测量脉搏和血压。
在儿科安慰剂对照研究中,相对于安慰剂组,盐酸托莫
西汀组的患者的平均心率加快6次/分钟。在停药之前的最
后随访中,相对于安慰剂组中的0. 2%( 2/850).盐酸托
莫西汀组中有2. 5%(36/1434)的患者心率增快25次/分
钟,心率至少为110次/分钟,且有1.1%(15/1417)的患
者不止一次出现心率增快25次/分钟,心率至少为110次/分
钟。心动过速不良事件盐酸托莫西汀组为0.3%( 5/159
7),安慰剂组为0%(0/934)。平均心率增快在强代谢
( EM)患者中为5.0次/分钟,而弱代谢者(PM)中为
9.4次/分钟。
相对于安慰剂组,接受盐酸托莫西汀治疗的儿童患者的
收缩压和舒张压平均升高1.6和2.4mmHg。在停药之前的
最后随访中,盐酸托莫西汀组4.8%( 59/1226)和安慰剂
组3.5%(26/748)的患者出现高收缩压,出现2次或2次以
上的在盐酸托莫西汀组有4.4%(54/1226),安慰剂组有
1.9%(14/748);盐酸托莫西汀组有4 .0%(50/262)和安
慰剂组有1.1%(8/759)的患者出现高舒张压,出现2次或
2次以上的盐酸托莫西汀组为3.5%(44/262),安慰剂组
为0.5%(4/759)。(高收缩压和高舒张压值是依据超过
第美国国家高血压教育工作组关于在儿童和青少年中高血
压控制中定义的按年龄、性别和身高分层的95%分位数而
定。)
在成人的安慰剂对照研究中,相对于安慰剂组,盐酸托
莫西汀组的患者出现平均心率加快5次/分钟。心动过速不
良事件在盐酸托莫西汀组为1.5%(8/540),而安慰剂组
为0.5%(2/402)。
盐酸托莫西汀组的成人患者平均收缩压和舒张压分别比
安慰剂组升高约2mmHg和1mmHg。在停药之前的最后随
访中,盐酸托莫西汀组2.2%(11/510)和安慰剂组1.0%
(4/393)的患者收缩压≥150mmHg;盐酸托莫西汀组有
0 4%(2/510)和安慰剂组有0.5%(2/393)的患者舒张
压≥100mmHg。没有发现成人患者出现高收缩压或高舒
张压超过1次。
在使用盐酸托莫西汀的患者中有出现直立性低血压和晕厥
的报道。在儿童和青少年研究中,使用盐酸托莫西汀治疗
的患者中有0.2%(12/5596)发生直立性低血压,0.8%
(46/5596)出现晕厥。在短期儿童和青少年对照研究中,
盐酸托莫西汀组有1.8%(6/340)出现体位性低血压,而
安慰剂组为0.5%(1/207),没有出现晕厥的报道。使用
盐酸托莫西汀应注意可能使患者出现低血压。
外周血管影响 上市后自发报告中有出现雷诺现象
(Ravnaud,s phenomenon)的报道(新出现或既有症状
的加重)。
新精神疾病或躁狂症状
在没有精神或躁狂病史的儿童及186例青少年中使用常
规剂量的托莫西汀,治疗过程中出现精神病或躁狂症状
(如幻觉、妄想或躁狂等)。如果出现这类症状,应考虑
可能与托莫西汀有关,应中止治疗。根据对多项短期、安
慰剂对照研究的汇总分析,相比安慰剂组1056例中无一例
发生,托莫西汀治疗组患者的上述症状发生率为0.2%(使
用常规剂量托莫西汀的1939例患者中数周后有4例出现上
述症状)。
对双相情感障碍患者的筛查
通常,治疗ADHD并伴有双相情感障碍的患者应该给予
特别的关注,这是因为对于具有双相情感障碍危险的患者
在治疗时可能会诱发混合型发作或躁狂发作。对于以上描
述的任何一种症状是否表示这种转变还不得而知。然而,
在开始接受盐酸托莫西汀胶囊治疗前,应该对伴有抑郁症
状的患者进行充分的筛查以确定患者是否具有发生双相情
感障碍的风险。筛查包括:详细的精神病史,包括自杀,
双相情感障碍和抑郁的家族史。
攻击行为或敌意
在儿童或青少年的ADHD患者中容易观察到攻击行为或敌
意,应注意监察ADHD患者接受治疗后其攻击行为或敌意是
否出现或加重。在短期对照临床研究中,根据自发报道安
慰剂组患者因治疗引起与敌意有关的不良事件9/806
(1.1%),托莫西汀组为21/308(1.6%)。尽管尚没有
确切证据显示盐酸托莫西汀会导致攻击行为或敌意.但在
儿童或青少年的临床试验中,与安慰剂组相比,用盐酸托
莫西汀后产生攻击行为或敌意的发生率较大(总的风险比
为1.33,[95%C.l.0.67-2.64.没有统计学差异])。
过敏事件
虽不常见,但在服用盐酸托莫西汀的患者中有发生过敏
反应的报告,包括血管神经性水肿、荨麻疹和皮疹。
对排尿的影响
在成人ADHD对照研究中,盐酸托莫西汀组中尿潴留出现
率为(1.7%,9/540).排尿不畅出现率为(5.6%,
30/540),而安慰剂组尿潴留出现率为(0%,0/402),排
尿不畅出现率为(0.5%,2/402)。因为尿潴留托莫西汀组
有2名成人患者退出研究,而安慰剂组没有。因此,尿潴留
和排尿不畅认为与托莫西汀有潜在的关联。
持续的阴茎异常勃起
上市后报告显示盐酸托莫西汀治疗的儿童和成人在极个
别的情况下可能出现持续4小时以上伴有疼痛或无痛的阴茎
异常勃起。在随访患者中勃起问题均得到了解决,一些患
者是在停止使用盐酸托莫西汀后得以解决。疑似的持续的
阴茎异常勃起需迅速采取医疗措施。
对生长发育的影响
在几个开放试验中将受试者体重和身高的变化与标准值
进行比较从而总结出盐酸托莫西汀对生长发育的长期影
响。一般来说,在经过最初的9-12个月的治疗之后,患
者的体重和身高的增长落后于根据标准人群预计的值。当
治疗达3年时,体重的增长开始回弹,平均增长17.9kg.比
根据基线数据的预计值高0.5kg。身高方面,在经过12个月
的治疗后,身高的增长趋于稳定,治疗达3年时,患者身高
平均增长19.4cm.比根据基线数据的预计值低0.4cm(见
下面图1)。
这种生长模式大致相同,与患者接受治疗时的发育程度
无关。尚未进入青春期的儿童患者(女孩≤8岁,男孩≤
9岁)接受治疗3年后体重平均增长2.1kg,身高平均增长
1.2cm,低于预计值;已经处于青春期(8岁(女孩≤13
岁,9岁<男孩≤14岁)或者青春期后期(女孩>13岁,男
孩>14岁)的儿童患者接受治疗3年后体重和身高的平均增
长值接近或超过预计值。
对于强代谢患者(EM)和弱代谢患者(PM),生长发
育的模式相似。接受治疗2年后,弱代谢患者的体重和身高
分别比预计值少2.4kg和1.1cm,强代谢患者的体重和身高
分别比预计值少0.2kg和0.4cm。
在短期对照试验中(9周以内),接受盐酸托莫西汀胶囊
治疗的患者体重平均减少0.4kg.身高平均增长0.9cm,而
接受安慰剂的患者体重平均增长1.5kg.身高平均增长
1.1cm。在一项固定剂量对照试验中,对于对照组、
0.5mg/kg/日剂量组、1.2mg/kg/日剂量组和1.8mg/kg/日剂
量组中,分别有1.3%,7.1%.19.3%和29.1%的患者体重
减轻了3.5%。
在盐酸托莫西汀胶囊的治疗过程中必须对患者的生长发
育进行监测。
实验室检查
不需要常规实验室检查。
CYP2D6代谢:服用盐酸托莫西汀后,相对于CYP2D6强
代谢( EM)者,弱代谢(PM)者的AUC会高10倍,最大
血浆浓度会高5倍。大约7%的高加索人为PM。实验室检查
能够鉴定CYP2D6 PM。在PM的血浆水平与给予
CYP2D6强抑制剂后相近。在PM中高的血浆水平会导致服
用盐酸托莫西汀后的不良反应率较高(见【不良反
应】)。
与CYP2D6强抑制剂联台使用或用于CYP2D6弱代谢患者
托莫西汀主要是通过CYP2D6途径代谢为4-羟基托莫西
汀。与CYP2D6强抑制剂C如帕罗西汀、氟西汀和奎尼
丁)联合使用或CYP2D6弱代谢患者(PM)使用时,有必
要调节盐酸托莫西汀的剂量。(参见【用法用量】和【药
物相互作用】)
【孕妇及哺乳期妇女用药】
妊娠
未在孕妇中进行充分的和规范的对照研究。盐酸托莫西
汀不应在妊娠期使用,除非潜在的利益大于对胎儿潜在的
危险性。
大鼠分娩不受托莫西汀影响。目前尚不清楚盐酸托莫西
汀对人类分娩的影响。
盐酸托莫西汀和/或其代谢产物在大鼠乳汁中排泌。目前
尚不清楚盐酸托莫西汀是否在人类的乳汁中排泌。哺乳期
母亲应慎用盐酸托莫西汀。
【儿童用药】
任何人考虑在儿童或青少年中使用盐酸托莫西汀胶囊,
必须对其使用的风险和临床的需要进行权衡(参见关于自
杀意念的警告语及【注意事项】)。
盐酸托莫西汀对年龄小于6岁的儿科患者的安全性和疗效
尚未确定。在幼年大鼠中进行了托奠西汀对成长、神经行
为和性发育影响的研究。大鼠自出生后早期(10日龄)至
成年,经口给予托莫西汀1、10和50mg/kg/日(以
mg/m2为单位计算,分别约为人最高剂量的0.2、2和8
倍)。结果可见阴道角张开(所有剂量)和包皮分离
(10和50mg/kg)轻度延迟,附睾重量和精子数轻度减少
(10和50mg/kg),黄体的轻度减少(50mg/kg),但未见对
生育力和生殖行为的影响。50mg/kg组可见门齿萌出现轻度
延迟。在15日龄(雄性10和50mg/kg,雌性50mg/kg)和
30日龄(雌性50mg/kg)可见活动轻度增强,但在60日龄
未见该异常。对于学习和记忆的影响。这些发现对人类的
意义尚不明确。
【老年用药】
盐酸托莫西汀在老年患者中安全性和疗效尚未确定。
【药物相互作用】
单胺氧化酶抑制剂
见【禁忌】
CYP2D6抑制剂
在强代谢(EM)者中,CYP2D6抑制剂(如帕罗西汀,
氟西汀和奎尼丁)使托莫西汀的稳态血浆浓度增加与弱代
谢(PM)者相近,有必要调节盐酸托莫西汀的剂量(见
【用法用量】)。在个别联合使用帕罗西汀或氟西汀的
EM中,比单独使用托莫西汀,托莫西汀的AUC大约高6-
8倍,Css、Cmax高3-4倍。
体外研究显示,在PM联合使用细胞色素P450抑制剂,托
莫西汀的血浆浓度不会增高。
托莫西汀对P450酶的作用
托莫西汀不会产生具有临床意义的对P450酶的抑制或诱
导,包括CYP1A2,CYP3A,CYP2D6和CYP2C9。
CYP3A底物(如咪达唑仑)盐酸托莫西汀(60mg.每
日2次,给药12天)与咪达唑仑(5mg单剂量,一种经
CYP3A4代谢的模型药物】同时给药导致咪达唑仑AUC增
加15%,但不推荐对经CYP3A代谢的药物进行剂量调整。
CYP2D6底物(如地昔帕明)盐酸托莫西汀(40或
60mg,每日2次,给药13天)与地昔帕明(50mg单剂
量,种经CYP206代谢的模型药物)同时给药不改变地昔
帕明的药代动力学,联合用药时不推荐对CYP2D6代谢的
药物进行剂量调整。
升压药
由于盐酸托莫西汀可能影响血压,与升压药(如多巴
胺、多巴酚丁胺)台用时应慎重。
乙醇
同时使用盐酸托莫西汀和乙醇,并不会改变乙醇的兴奋
作用。
沙丁胺醇
给予正在系统给药(口服或静脉注射)沙丁胺醇(或其
他β2激动剂)的患者盐酸托莫西汀需要注意,因为沙丁胺
醇可能导致心率加快和血压升高。沙丁胺醇(2小时静注
600微克)诱导心率加快和血压升高。托莫西汀(60mg,每
日2次,给药5天)会增强这些作用,并且沙丁胺醇与托莫
西汀在初始同时给药时这种作用最为明显。然而在另一项
排除了弱代谢者的研究中.21例健康亚洲人同时给予沙丁
胺醇吸入剂(200-800微克)和托莫西汀(80mg.每日
1次,给药5天)未发现对心率和血压的影响。
哌甲酯
与单独服用哌甲酯相比,盐酸托莫西汀与哌甲酯合用并
不增加对心血管的影响。
高血浆蛋白结合率的药物
在体外研究中,进行了托莫西汀和高血浆蛋白结合率药
物在治疗浓度下的药物置换研究。托莫西汀不影响华法
令、乙酰水杨酸、苯妥英钠或安定与人白蛋白的结台。同
样,这些化合物也不影响托莫西汀与人白蛋白的结合。
影响胃液pH值的药物
升高胃液pH值的药物(氢氧化镁/氢氧化铝,奥美拉唑)
不影响盐酸托莫西汀的生物利用度。
【药物过量】
临床试验中盐酸托莫西汀过量的病例有限,没有致命的
病例报道。在上市后有报道混合摄入过量盐酸托莫西汀和
至少其它一种药物引起死亡,没有单独过量使用盐酸托莫
西汀包括有意提高剂量至1400mg导致死亡的报道,在涉
及盐酸托莫西汀过量的患者中曾报道发生过癫痫,据报道
伴随短期、长期盐酸托莫西汀药物过量的最常见症状是嗜
睡,激动,活动过度,行为异常和胃肠道系统症状。与交
感神经系统相关的轻中度症状和体征(瞳孔扩大,心动过
速,口干)也有报道,较为少见的报道有QT期延长及精神
分裂,包括定向障碍和幻觉等。
药物过量的处理
保证周围通风;用适当的指征显示及其他支持措施监测
心脏和生命体征。服药过量后短时间内建议洗胃。使用活
性炭可以限制药物吸收。由于托莫西汀蛋白结合率高.所
以如用透析来处理药物过量没有很大用处。
【药理毒理】
盐酸托莫西汀是一种选择性去甲肾上腺素再摄取抑制
剂。托莫西汀治疗注意缺陷/多动障碍( ADHD)的确切机
制尚不清楚,但体外神经递质摄取和耗竭试验结果显示,
可能与其选择性抑制突触前膜去甲肾上腺素转运体有关。
毒理研究
遗传毒性
盐酸托莫西汀Ames试验、小鼠淋巴瘤细胞体外试
验、CHO细胞染色体畸变试验、大鼠肝细胞程序外
DNA合成(UDS)试验、小鼠微核试验结果均为阴性,
但CHO细胞二倍染色体百分率轻度升高,提示有核内复
制(数目畸变)。代谢产物盐酸N-去甲基托莫西汀
Ames试验、小鼠淋巴瘤试验和UDS试验结果均为阴
性。
生殖毒性
大鼠掺食法给予盐酸托莫西汀,剂量达57mg/kg/日
(按mg/m2推算,相当于人最高用量的6倍),未见对生
育力的影响。
妊娠大鼠器官形成期经口给予托莫西汀达
150mg/kg/日(按mg/m2推算,相当于人最高用量的
17倍),未见对胎鼠有不良影响。妊娠家兔器官形成期
经口给予托莫西汀达100mg/kg/日,在该剂量的3个试
验中有1个试验可见存活胎仔减少和早期吸收增加。在
出现轻微母体毒性的剂量下,可见胎仔非典型性颈动脉
起端及锁骨下动脉缺乏发生率轻度增加。无上述影响的
剂量为30mg/kg/日。按mg/m2推算,家兔100mg/kg剂
量相当于人最高用量的23倍,此剂量下家兔的血浆中托
莫西汀水平(以AUC计)估测为人最大剂量下的3.3倍
(强代谢)或者0.4倍(弱代谢)。
大鼠掺食法给予盐酸托莫西汀50mg/kg/日(按mg/m2推
算,约相当于人最高用量的6倍),从交配前2周(雌性)
或10周(雄性)至器官形成期、哺乳期连续给药,进行了
2次试验.1个试验可见幼鼠体重和存活率减少。在
25mg/kg剂量下也可见幼鼠存活率减少,13mg/kg剂量组
未见减少。
大鼠掺食法给予盐酸托莫西汀40mg/kg/日(按mg/m2推
算,相当于人最高用量的5倍),从交配前2周(雌性)或
10周(雄性)至器官形成期给药,可见雌性胎仔体重降低
和椎弓骨化不完全发生率增多,在20mg/kg/日剂量下未见
上述异常。
致癌性
大鼠和小鼠掺食法给予盐酸托莫西汀连续2年,剂量分别
达47和458mg/kg/日,未见致癌性。按mg/m2推算,大鼠试
验中的最高剂量约分别为儿童和成人中最高用量的8倍和
5倍,该剂量下大鼠AUC估测为人用最高剂量下AUC的
1.8倍(强代谢)或0.2倍(弱代谢)。按mg/m2推算,小
鼠试验中的最高剂量分别约为儿童和成人中最高用量的
39倍和26倍。
【药代动力学】
口服托莫西汀后吸收良好,受食物的影响很小。它主要
通过氧化代谢清除,包括细胞色素P450 2D6 (CYP2D6)酶途
径和随后的葡萄糖醛酸化。托莫西汀的半衰期约为5小时。
小部分为CYP2D6代谢的药物的弱代谢(PM)人群(大约
7%的高加索人和2%的非洲裔美国人,中国人群
CYP2D6代谢为PM的发生率为1%)。与正常代谢人群
[强代谢(EM)]相比,这群人的代谢行为减慢,表现为
高10倍的AUC,高5倍的最大血浆浓度和较慢的清除率
(血浆半衰期大约为24小时)。抑制CYP2D6的药物,如
氟西汀、帕罗西汀和奎尼丁会引起同样的增高。
对参加某些临床试验的400多名儿童和青少年进行了托
莫西汀药代动力学的评价,主要选用了群体药代动力学研
究。也获得了儿童、青少年和成人的单剂量和稳态的个体
药代动力学数据。在以mg/kg标准计的剂量下,在给儿
童、青少年和成人观察到相似的半衰期、Cmax和AUC。
经体重校正后的清除率和分布容积也相似。
吸收和分布 口服托莫西汀后迅速吸收,在EM和PM的绝
对生物利用度分别约为63%和94%。服用后,大约在1-
2小时达到最大血药浓度(Cmax)。
盐酸托莫西汀可与食物同时或分开服用。对于成人,盐
酸托莫西汀与标准的高脂肪饮食一起服用不影响托莫西汀
的口服吸收程度(AUC),但确实减少吸收速率,使
Cmax降低37%,Tmax延迟3小时。在临床研究中,儿童
和青少年同时服用盐酸托莫西汀和食物,会使Cmax降低
9%。
静脉注射给药后,稳态分布容积为0.85L/kg.提示托莫
西汀主要分布在全身体液中。校正体重后,同一体重范围
的患者分布容积相似。
在治疗浓度血浆中,98%的托莫西汀与蛋白结合,主要
是与白蛋白结合。
代谢和清除 托莫西汀主要通过CYP2D6酶途径代谢。与
正常代谢行为人群(EM)相比,在此途径的慢代谢人群
(PM)中,会有较高的托莫西汀血浆浓度。与EM人群相
比,在PM人群,托莫西汀的AUC大约高10倍、Css、
Cmax约高5倍。实验室检查可以鉴别CYP2D6 PM。盐酸
托莫西汀与潜在的CYP2D6抑制剂联合使用,如氟西汀、
帕罗西汀或奎尼丁会引起托莫西汀血浆浓度的实质性升
高,有必要调节给药剂量(见【药物相互作用】)。托莫
西汀对CYP2D6途径不抑制或削弱。
无论CYP2D6状态如何,形成的主要氧化代谢产物都是
4-羟托莫西汀,该产物会被葡萄糖醛酸化。作为去甲肾上
腺素转运体抑制剂.4-羟托莫西汀与托莫西汀具有同等效
能,但在血浆中浓度很低(在EM中为托莫西汀浓度的
1%.在PM中为托莫西汀的浓度0.1%)。
4-羟托莫西汀主要由CYP2D6催化形成,但在PM中,有
较低比率的4-羟托莫西汀由其他细胞色素P450酶代谢而
成。N-去甲基托莫西汀由CYP2C19和其他细胞色素
P450酶代谢而成,但是,与托莫西汀相比药理活性非常
低,在血浆中的浓度也较低(在EM中为5%的托莫西汀浓
度,在PM中为45%的托莫西汀浓度)。
成人口服后,在EM人群中,托莫西汀的平均表现血浆清
除率为0.35L/hr/kg,平均半衰期为5.2小时。口服托莫西
汀,在PM人群中,平均表观血浆清除率为0.03L/hr/kg,平
均半衰期为21.6小时。与EM相比,在PM,托莫西汀的
AUC约高10倍、Css、Cmax约高5倍。在EM人群,4-羟
托莫西汀的消除半衰期与N-去甲基托莫西汀相似(6-8小
时),但在PM人群中,N-去甲基托莫西汀的半衰期较长
(34-40小时)。
托莫西汀主要以4-羟托莫西汀-O-葡萄糖醛酸排出体
外,主要经尿排泄(剂量的80%以上),而经粪便排出较
少(不到剂量的17%)。只有很小一部分盐酸托莫西汀以
托莫西汀原型排泄(不到剂量的3%),提示该药的生物转
化较多。
特殊人群
肝功能不全者 与正常人群相比,伴中度( Child - Pugh
Class B)(2倍增高)和重度(Child-Pugh Class C)
(4倍增高)肝功能不全者的EM患者.托莫西汀的暴露量
(AUC)增高。建议对中度或重度肝功能不全的患者调整
剂量(见【用法用量】)。
肾功能不全者 与正常人群相比,患终末期肾脏疾病的
EM患者,具有较高的托莫西汀的暴露量(约增高65%),
但根据体重对剂量校正后,与前者没有差异。因此,对终
末期肾脏疾病的患者或严重程度稍低的肾功能不全的
ADHD患者,可给予常规剂量的盐酸托莫西汀。
老年患者 托莫西汀还未在老年人群中进行药代动力学评
价。
儿童 在儿童和青少年中,托莫西汀的药代动力学与成人
相似。托莫西汀的药代动力学尚未在6岁以下的孩子中评
价。
性别 性别不影响托莫西汀的分布。
种族 种族一般不影响托莫西汀的分布(除PM在高加索
人中较普遍这一因素)。
【贮 藏】密封,在干燥处保存。
【包 装】铝塑包装,10粒/板,1板/盒、2板/盒、3板/盒。
【有 效 期】24个月
【执行标准】YBH03972013
【批准文号】国药准字H20133346
【生产企业】
企业名称:港澳免费资料大全
生产地址:江苏省盐城市大丰区健康东路103号
邮政编码:224100
电话号码:0515-83514661
传真号码:0515-83526010
网址:




 苏公网安备 32098202000163号
苏公网安备 32098202000163号